Francis William Aston: Entdeckung der Isotope. Der englische Chemiker und Physiker Francis William Aston entdeckte seinerzeit 200 der 287 natürlich vorkommenden Isotope. Francis William Aston wurde am ersten September 1877 im heutigen Birmingham geboren und nahm nach Abschluss seiner schulischen Laufbahn zunächst ein Studium in Chemie auf. Weil ihn die damaligen Entwicklungen in der Physik reizten, studierte er hiernach über ein Stipendium noch die Wissenschaften der Physik. Nach diesem Abschluss konzentrierte er sich auf die Physik der Gasentladungsröhre und entdeckte während einer Glimmentladung direkt an der Kathode eine hauchfeine, dunkle Schicht, welche als der “Astonsche Dunkelraum” (Aston Dark Space) benannt wurde.
Nach einer Einladung vom Cavendish-Laboratorium in Cambridge beschäftigte sich der Naturwissenschaftler ab 1909 mit der Identifizierung der Neonisotope, für die er auch Vorlesungen am Trinity College hielt. Bis 1919 waren diese Arbeiten durch den ersten Weltkrieg unterbrochen, hiernach identifizierte er mit einem von ihm 1918 gebauten Massenspektrometer (er baute das erste funktionierende) 200 der 287 natürlich vorkommenden Isotope. Schon 1919 wurde von ihm ein Postulat veröffentlicht, welches die extrem energiereiche Fusion von Wasserstoff und Helium beschrieb.
Drei Jahre später, 1922, erhielt er den Nobelpreis in Chemie: „für seine Entdeckung von Isotopen, darunter weitgehend die nicht-radioaktiver Elemente unter Zuhilfenahme seines Massenspektrographen und für seine Formulierung der „Regel der Ganzzahligkeit“.
Diese Regel der Ganzzahligkeit, auch als Astonsche Isotopenregel bekannt, besagt, dass chemische Elemente mit einer ungeraden Ordnungszahl nie mehr als zwei stabile Isotope besitzen – jene mit gerade Ordnungszahl haben oft bedeutend mehr.
Wegen seiner hohen Bedeutung wurde er in die Royal Society aufgenommen; auch ein Mondkrater wurde ihm zu Ehren “Aston” genannt.
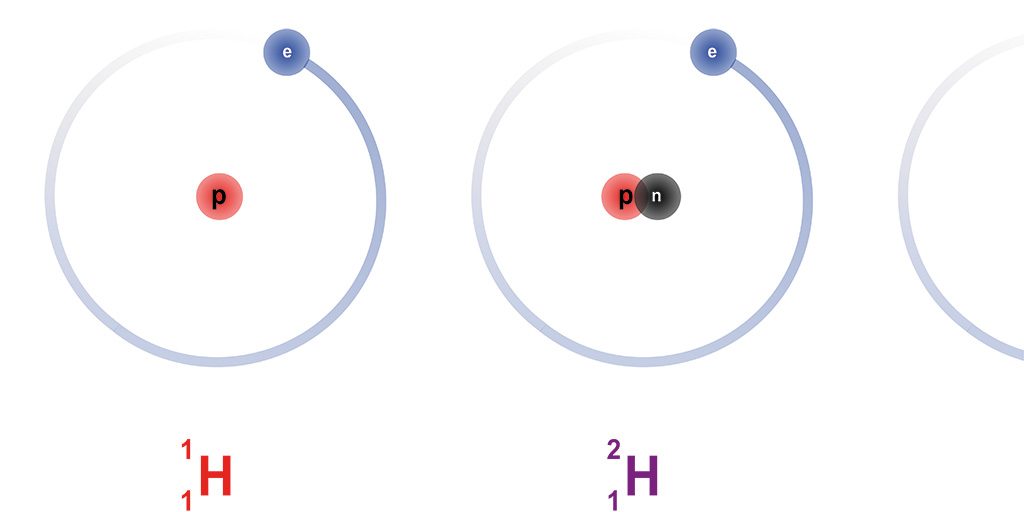
Als Isotope bezeichnet man Arten von Atomen, deren Atomkerne gleich viele Protonen (gleiche Ordnungszahl), aber verschieden viele Neutronen enthalten. Sie haben dann verschiedene Massenzahlen, stellen aber das gleiche Element dar; es gibt also die Sauerstoffisotope, die Eisenisotope usw. Die Isotope eines Elements verhalten sich chemisch fast identisch.
Die Bezeichnung Isotop ist älter als der Begriff Nuklid, der ganz allgemein „Atomart“ bedeutet. „Isotop“ wird daher nach wie vor oft auch im Sinne von Nuklid benutzt, d. h., auch dann, wenn nicht nur von Atomen eines und desselben Elements die Rede ist.
Von jedem bekannten Element, mit Ausnahme des erst 2006 entdeckten Oganesson, sind mehrere Isotope nachgewiesen (s. Liste der Isotope). Insgesamt gibt es rund 3300 Nuklide. Etwa 250 davon sind stabil. Alle anderen sind instabil, d. h., durch radioaktiven Zerfall wandeln sie sich nach mehr oder weniger langer Zeit in andere Atome um.
Von den 91 natürlich vorkommenden Elementen werden in der Natur 69 als Gemische mehrerer Isotope (Mischelemente) vorgefunden. Die übrigen 22 heißen Reinelemente. Das chemische Atomgewicht von Mischelementen ist der Durchschnittswert der verschiedenen Atommassen der beteiligten Isotope.
Der Name (von griechisch ἴσος ísos „gleich“ und τόπος tópos „Ort, Stelle“) kommt daher, dass die Isotope eines Elements im Periodensystem am gleichen Ort stehen. Getrennt voneinander dargestellt werden sie in einer Nuklidkarte. Der Begriff Isotop wurde von Frederick Soddy geprägt, der für seine Arbeiten und Erkenntnisse im Bereich der Isotope und Radionuklide 1921 den Nobelpreis für Chemie erhielt.