Von der Atomvorstellung Demokrits bis zur Entdeckung des Atomkerns durch Rutherford war es ein weiter Weg, den inneren Aufbau der Materie zu erforschen. Die Frage nach dem Wesen der Materie beschäftigt Philosophen und Naturforscher seit der Antike. Woraus bestehen die Stoffe unserer Alltagswelt, die uns in ihrer Vielfalt und Schönheit umgeben, und wie sind sie zusammengesetzt? Bereits die griechischen Philosophen erörterten diese Frage, wobei Leukipp im 5. Jahrhundert v. Chr. den Standpunkt vertrat, Materie sei nicht unendlich teilbar, sondern bestehe aus kleinsten Teilchen. Demokrit, ein Schüler Leukipps, nannte sie „atomos“, das griechische Wort für „unteilbar“. Im weiteren Verlauf setzte sich jedoch Aristoteles Auffassung der 5 Elemente durch, die die Naturwissenschaft der folgenden zwei Jahrtausende prägte. Die Vorstellungen über die Natur der Stoffe und Körper änderten sich dadurch bis ins 16. und 17. Jahrhundert nicht wesentlich.
Materie besteht aus Atomen – experimentelle Untermauerung
Eine experimentelle Untermauerung bekam die atomistische Idee erst in der Neuzeit, einhergehend mit einer Hinwendung zu einer naturwissenschaftlichen Vorgehens- und Denkweise. Im 18. und 19. Jahrhundert entdeckte man zahlreiche chemischen Elemente, vor allem mit Hilfe der Elektrolyse und der Spektroskopie. Dimitrij Mendelejew entwickelte das Periodensystem, indem er die damals bekannten Elemente zu Gruppen mit chemisch ähnlichem Verhalten zusammenstellte. John Dalton griff zu Beginn des 19. Jahrhunderts die alte Vorstellung von den Atomen wieder auf und konnte mit Hilfe seines Gesetzes der konstanten Proportionen nachweisen, dass alle chemischen Elemente tatsächlich aus kleinsten Teilchen bestehen mussten. Er schloss, dass sich aus den unterschiedlichen Atomgewichten charakteristische Atome für die einzelnen Elemente ergeben sollten.
Rutherford gelingt der Nachweis, dass Atome nicht die kleinsten Teilchen sind
Die Vorstellung, dass das Atom unteilbar sei, musste dann Anfang des 20. Jahrhunderts aufgegeben werden. Joseph Thomson entdeckte 1897 die negativ geladenen Elektronen, die er als Bestandteile des Atoms identifizierte. Er nahm an, dass diese Elektronen in die positive geladene Masse des Atoms eingebettet seien wie Rosinen in einen Kuchen. Dass dieses einfache Atommodell nicht stimmte, konnte Ernest Rutherford zusammen mit seinen Doktoranden Hans Geiger und Ernest Mardsen 1911 zeigen. Sie unternahmen Streuversuche, bei denen Alphateilchen aus einer radioaktiven Quelle, dem Radium, auf eine nur wenige tausend Atome dicke Goldfolie geschossen wurden. Um zu sehen, wohin die Teilchen flogen, entwickelten sie einen speziellen Sichtschirm, eine Glasplatte, die mit szintillierendem Zinksulfid beschichtet war, das aufleuchtete, wenn es von einem Teilchen getroffen wurde.
Rutherfords Streuexperimente – der Atomkern wird entdeckt
Rutherford und seine Mitarbeiter bemerkten, als sie ihren Schirm an verschiedenen Stellen rund um die Folie aufstellten, dass in einigen Fällen die radioaktiven Geschosse wieder zurückflogen. Dementsprechend musste sich also irgendwo im Inneren ein kleiner Körper mit hoher Dichte befinden, der in der Lage war, ein schnell fliegendes Teilchen nicht nur abzulenken, sondern zurückprallen zu lassen. Andererseits beobachteten sie viele Teilchen, die die Folie ungehindert durchdringen konnten. Diese Masse musste sich also auf einen winzig kleinen Raum konzentrieren.
Dieses Versuchsergebnis kann man sich so vorstellen: Wenn man eine Stahlkugel in weiche Watte einpackt und dann mit Schrot beschießt, fliegen die meisten Schrotteilchen durch die Watte nahezu ungehindert hindurch. Einige wenige allerdings treffen die Kugel in der Mitte und prallen zurück. An diesen Querschlägern lässt sich erkennen, dass sich etwas Kleines und Hartes in der Watte befindet. Sehr erstaunlich war auch, dass der größte Teil des Atoms weitgehend leer sein musste: Die Teilchen der radioaktiven Quelle flogen durch die Goldschichten nahezu ungehindert hindurch, ein nur schwer vorstellbares Ergebnis, das der augenscheinlichen Festigkeit von Materie widersprach.
Das Atom ist fast völlig leer
Wie man heute weiß, ist das Atom sogar fast völlig leer. Seine Substanz steckt in dem unwahrscheinlich kleinen Kern. Würde man den leeren Raum zwischen den Atomkernen des Wassers in den großen Weltmeeren entfernen, so erhielte man einen komplett gefüllten Würfel mit einer Seitenlänge von noch nicht einmal 20 m. So ist es auch vorstellbar, dass ungeheure Gravitationskräfte die Atome in den äußerst dichten Neutronensternen bis aufs Äußerste zusammenpressen können. In normaler Materie, die uns umgibt, wird der leere Raum durch die abstoßenden Kräfte zwischen Atomkern und Elektronenhülle erzielt. Wie in einem Kettenkarussell hält die Fliehkraft die herumschwirrenden Elektronen auf Distanz.
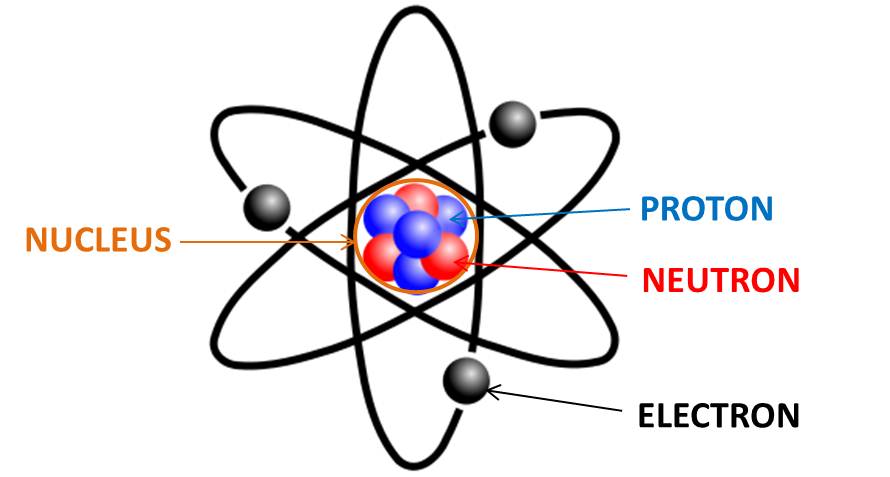
In Rutherfords Atommodell, das einem Planetensystem ähnelt, bestehen Atome aus einem schweren, positiv geladenen Atomkern, der praktisch die gesamte Masse des Atoms in sich vereint, und einer leichten, negativ geladenen Elektronenhülle um diesen Kern herum. Atome sind unvorstellbar klein, die Größenordnungen kann man sich nur durch Vergleiche klarmachen: Wenn der Atomkern die Größe eines Stecknadelkopfes hat, dann ist der Abstand zur Elektronenhülle unwahrscheinlich groß, er entspricht etwa der Größe eines Fernsehturms.
Blick über den Tellerrand: Der Atomkern bleibt zunächst unbekannt
Auch in Rutherfords Labor konnte zunächst niemand etwas mit den unverständlichen Streuergebnissen anfangen. Erst allmählich setzte sich die Idee eines Atomkerns in einem ansonsten leeren Atom durch. Und Rutherford selbst hat den Begriff „Atomkern“ auch erst ein oder zwei Jahre nach den Streuversuchen geprägt. Die neuen Erkenntnisse der Rutherford-Gruppe schlugen übrigens keineswegs wie eine Bombe ein. Rutherford hatte zwar experimentell die innere Struktur der Atome nachgewiesen, die Wichtigkeit seiner Arbeiten wurde in seiner Zeit aber kaum oder nur zögerlich beachtet. Noch zwei Jahre später referierte ein Nobelpreisträger auf einer Konferenz über die Struktur des Atoms, ohne den Atomkern zu erwähnen.
Auch wenn es immer mal wieder behauptet wird: Rutherford hat mit seinen Alphateilchen den Atomkern nicht gespaltet! Die Teilchen wurden lediglich gestreut, also abgelenkt. Die erste Kernspaltung gelang Otto Hahn, Friedrich Strassmann und Lise Meitner im Dezember 1938. Und zwar spaltete die Arbeitsgruppe natürliches Uran durch Beschuss mit Neutronen, konnte ihr durch chemische Analyse gewonnenes Messergebnis zunächst jedoch nicht deuten.